筋収縮系の自励振動現象(SPOC)と生理的意義
|
|---|
| 図1:心臓の階層構造 |
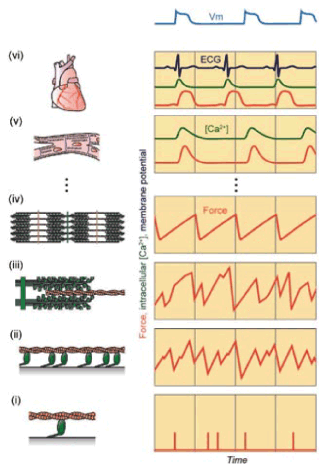
図1に心臓の構造的・機能的階層性を模式的に示した。まずこの階層の最上位に位置するヒトの心臓(vi)は、心筋細胞(v)の集合体である。心筋細胞(筋線維ともいう。ここでは、筋細胞から細胞膜を取り除いたタンパク質収縮要素を「筋収縮系」と呼ぶ)は多数の筋節(iv)が直列につながった筋原線維(筋収縮系として機能する単位構造体)の集合体であり、筋節(筋原線維を構成する最小単位)はミオシンフィラメント(緑色)とアクチンフィラメント(茶色)とが規則的に配列した液晶様の格子構造体である。そして、筋収縮運動を担うタンパク質集合体の最小単位として、一対のアクチンフィラメントとミオシン分子(分子モーター;iiとi)に行き着く。それぞれの図の右側のチャートは、各階層における発生力、Caイオン濃度、そして電気シグナル(ECG)の時間経過を表している。分子モーターとアクチンからなる分子レベルでは、運動(力)は確率的に発生するので、これを一般的に「確率的ナノマシン(Stochastic nanomachine)」と呼ぶ。 ナノマシンが多数集合し、規則性を持つ筋原線維のレベルになると、収縮・弛緩運動を周期的に繰り返す自励振動運動(SPOC)がみられるようになる(ivの右図)[1]。これはまさしく、確率的ナノマシンが多数個集合することによって生物機能に協同性が生まれることを示す典型的な例である。筋細胞の状態は、力を発生する活性化(ON:収縮)状態と、力を発生しない不活性化(OFF:弛緩)状態のいずれかであるといわれる。これを「全か無かの法則(All-or-none principle)」という。筋収縮のエネルギー源はATP(アデノシン3リン酸)であり、力学酵素の働きでATPがADPとPi(無機リン酸)に加水分解される際に放出される化学エネルギーの一部が使われて力学的仕事が生まれる。筋細胞では、Caイオン濃度がおよそ μM 以下だと制御タンパク質による抑制作用が働いて、弛緩状態にあり(ミオシン分子モーターがアクチンと強く結合できない)、Caイオン濃度が μM を超えると抑制が解除され、ミオシン分子モーターの酵素機能がフルに活性化されてON状態が実現することが分っている。そこで細胞膜を除去した筋収縮系では溶液環境を自由に整えることができるので、Caイオン濃度などの調節条件をONとOFFの中間条件に設定することが可能になる。Caイオン濃度に限らず、ONとOFFの中間状態を作ると、筋収縮系はSPOC状態になることを私たちは多くの実験を通じて証明してきた[2, 3]。
|
|---|
| 図2:筋収縮系の3次元状態図と 心筋収縮系のSPOC波形 |
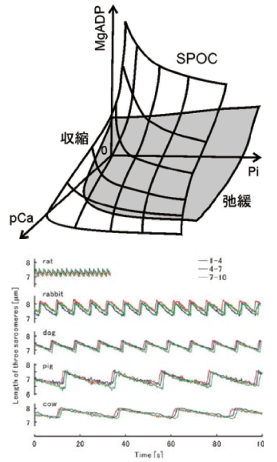
SPOCが発生する仕組みについての理解は進んだが、さて、この運動特性は生理的に意味のあるものなのかどうか、SPOCの生理的意義に興味が移る。その点については、我々はすでに、図2下図に示したように、中間活性化条件で発生するSPOCの筋節長の変動パターン(鋸波形)の周期が、ネズミ、ウサギ、イヌ、ブタ、ウシから調製した心筋線維において、それぞれの動物の静止心拍とほとんど線形の関係にあるという結果を得ている[6, 7]。また、動物種によるSPOC周期の違いは、筋線維を構成するミオシン分子モーターの分子種がそもそも異なっており、その、アクチンとの相互作用による酵素活性が、SPOC周期の順に低くなることに起因することも分った。さらに最近ヒトの心筋で同じ性質を研究しているが(シドニー大学との共同研究)、ちょうどブタに近いところで、同じ直線に乗ることが分ってきた。この事実は、筋収縮系の自励振動能が、心拍機能の構造的機能的基盤となっていることを期待させる。 さらに以上の結果は、心臓という臓器は、ナノ(分子モーターレベル)とマクロ(心臓レベル)とが直結する臓器であるという、新たな階層原理の存在を示唆するものである。マクロな心拍(力発生)によって、遠く離れたところにある分子モーターに「分子ひずみ」が生じ、ちょうどキネシンやミオシンVのような1分子で歩行運動する分子モーターで我々が証明したように(次節参照)、受動的に生じた分子ひずみによって分子モーターの酵素活性は変調されることになるだろう。このような化学・力学フィードバックループが幾つかの階層にまたがって存在すること、それが心臓という、動物の生死を左右する重要な臓器の機能を支える基本原理として存在しているのではないか。それが我々の得た帰結・主張である。[8, 9]
参考文献
[1] Shimamoto, Y. et al., Biochem. Biophys. Res. Commun. 366, 233-238 (2008) [article]
[2] Okamura, N. & Ishiwata, S., J. Muscle Res. Cell Motil. 9, 111-119 (1988) [article]
[3] Shimamoto, Y. et al., Biophys. J. 93, 4330-4341 (2007) [article]
[4] Ishiwata, S. et al., Adv. Exp. Med. Biol. 332, 545-556 (1993) [article]
[5] Sato, K. et al., Prog. Biophys. Mol. Biol. 105, 199-207 (2011) [article]
[6] Sasaki, D. et al., J. Muscle Res. Cell Motil. 26, 93-101 (2005) [article]
[7] Sasaki, D. et al., Biochem. Biophys. Res. Commun. 343, 1146-1152 (2006) [article]
[8] Ishiwata, S. et al., HFSP J. 4(3), 100-104 (2010) [article | PDF (215 KB)]
[9] Ishiwata, S. et al., Prog. Biophys. Mol. Biol. 105, 187-198 (2011) [article]
一分子顕微解析による分子機械の動作原理解明
すべての生物機能は、それ固有のタンパク質機能分子が組織化された階層構造によって担われている。本研究テーマでは、階層構造の最下層に位置付けられる、10から100ナノメートル(nm)の大きさのタンパク質一分子、すなわち「分子機械」を研究対象とする。光学顕微鏡システムによるナノレベルの顕微解析・操作技術を駆使し、「見る(imaging)」のみならず「操る(manipulation)」ことにより、分子機械の動作原理を解明する。
生体分子モーターのナノ酵素力学
|
|---|
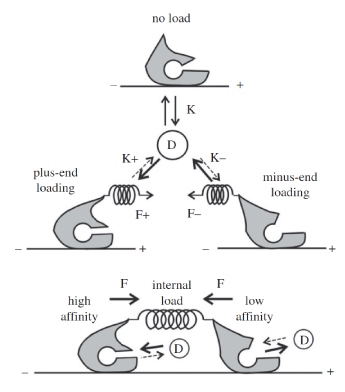
| 図1:キネシン一分子の運動における頭部間内部負荷とADP親和性の関係を示す模式図 |
化学エネルギーを力学的エネルギーに変換し、生物運動の根本を担う分子機械がミオシンやキネシンといった生体分子モーターである。化学物質を分解する化学的(chemical)な機能と、分子モーター自身が構造変化する機械的(mechanical)な機能がいかにして共役(coupling)するか、その巧妙な仕掛けを探るべく、光ピンセット(レーザー光を絞り込むことで、直径1 μm程度のポリスチレンビーズを捕捉してpNオーダーの力を加え、操作できる装置)を組み込んだ光学顕微鏡システムによって、分子モーターに負荷を加え、分子機能にどのような影響を与えるかを解析する[1, 2]。 本手法を、微小管上を歩行するキネシン [3-5]や、アクチンフィラメント上を歩行するミオシンV、ミオシンVI [6-8]といった分子モーターの機能解析に適用したところ、負荷を与える方向によって酵素活性の基質であるヌクレオチドの結合定数が大きく変化すること(図1)などが判明した。このような化学・力学特性は分子モーターの運動に「方向性」を与える極めて重要な性質である。 一方、こうした結果はリニアモーターの運動原理を示すにとどまらない。細胞分裂の際、両極から微小管を脱重合することにより染色体が両極へと移動する機能を支えるMCAK(微小管脱重合キネシン)を光ピンセットにより捕捉したところ、MCAK分子は1 pN程度の力を発生するが、微小管の脱重合は抑制された[9]。負荷の向きにより酵素機能が変調をうけるという性質は、力学酵素が担う生命現象の本質を突くものと推察される。
細胞骨格の構造-機能相関
|
|---|
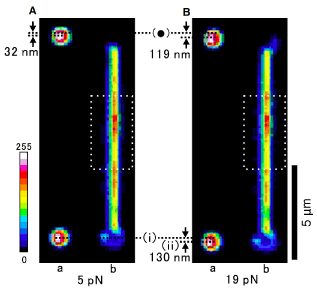
| 図2:両端に結合したビーズ(球状)を操作することにより生じたアクチンフィラメント(線状)の蛍光強度変化 |
微小管やアクチンフィラメントといった線維状重合体は、細胞内に骨格のように張り巡らされた細胞骨格を形成し、細胞の形状を維持するほか細胞変形の柱となる。こうした細胞骨格が伸展、歪曲といった様々な外力に曝されていることは明白である。そして、このような外力が細胞骨格の構造に影響を与えるかを評価するべく、部分的に蛍光ラベルしたアクチンフィラメントに光ピンセットで伸展力を与えたところ、蛍光強度が変化したことから「分子歪み」の存在が明らかとなった[10](図2)。外力に起因する分子歪みが、アクチン結合タンパク質との相互作用に影響を与え、細胞機能を制御する可能性を示唆するものである。
このように、力学酵素である分子モーターが力を発生し、その結果生じた分子歪みによって分子モーター自体の酵素機能が変調を受けるといった化学・力学フィードバックループ、そして細胞骨格の分子歪みによる細胞機能の制御といった、構造と機能の自己組織的分子メカニズムを、一分子顕微解析法によって解明することを目指している。
参考文献
[1] Nishizaka, T. et al., Nature 377, 251-254 (1995) [article]
[2] Nishizaka, T. et al., Biophys. J. 79, 962-974 (2000) [article]
[3] Kawaguchi, K. & Ishiwata, S., Science 291, 667-669 (2001) [article]
[4] Kawaguchi, K. et al., Biophys. J. 84, 1103-1113 (2003) [article]
[5] Uemura, S. & Ishiwata, S., Nat. Struct Biol. 4, 308-311 (2003) [article]
[6] Uemura, S. et al., Nat. Struct. Mol. Biol. 11, 877-883 (2004) [article]
[7] Oguchi, Y. et al., Proc. Natl. Acad. Sci. USA 105, 7714-7719 (2008) [article]
[8] Oguchi, Y. et al., Nat. Chem. Biol. 6, 300-305 (2010) [article]
[9] Oguchi, Y. et al., Nat. Cell Biol. 13, 846-852 (2011) [article]
[10] Shimozawa, T. & Ishiwata, S., Biophys. J. 96, 1036-1044 (2009) [article]
細胞分裂動態に潜む力による動作 · 制御メカニズムの解明
細胞分裂は複製された染色体を2つの娘細胞へ分配する過程である。この過程で染色体は、分裂面への整列(分裂前期~中期)、紡錘体極への移動(分裂後期)に伴う力を受ける。この分裂に関わる力を発生する装置が「紡錘体」と呼ばれる超分子構造である。紡錘体は微小管とさまざまな種類の分子モーターから構成され、微小管の重合・脱重合や、分子モーターが発生する力を直接的・間接的に染色体へ伝えている。本研究テーマでは、細胞分裂動態に潜む力による動作・制御メカニズム、すなわち、紡錘体内でこれらの力がどのように制御されているか、また紡錘体が発生する力が分裂にどのように関わっているかについて、イメージングと紡錘体・細胞の直接顕微操作・力測定技術を組み合わせることで解明することを目指している。
紡錘体の力学応答性と形態制御メカニズム
通常、細胞には細胞膜があり、その細胞内の紡錘体を物理的に顕微操作することは難しい。そこで私達は、アフリカツメガエルの未受精卵から抽出した細胞質溶液中で自己組織化される紡錘体を直接顕微操作し、細胞の中で起こる紡錘体形成や染色体分配の現象を、スライドガラス上で再現して任意に解析できる実験系を用いている。すでに私達は、この in vitro 紡錘体形成系にMEMSカンチレバー(注)を応用することによって、紡錘体の力学特性の直接操作・計測・解析を実現した(詳細)[1](図1)。その結果、紡錘体は粘弾性的な性質をもつことが明らかとなった。また、変形により紡錘体の内部構造を一時的に破壊(塑性変形)しても、安定な内部構造をもつ紡錘体が自発的に再構成されることも分かった。 最近、この再構成現象の解析により、顕微操作によって外部から紡錘体内の力バランスを変化させることで、細胞質環境と染色体数の変化を伴わずに、紡錘体の大きさを任意に規定できることも明らかとなってきている[2]。このように、力発生装置である紡錘体の構造の柔軟性や力学的性質の安定性が、正確な染色体分配を担保していると推察される。
|
|---|
| 図1:中期紡錘体の顕微操作像 |
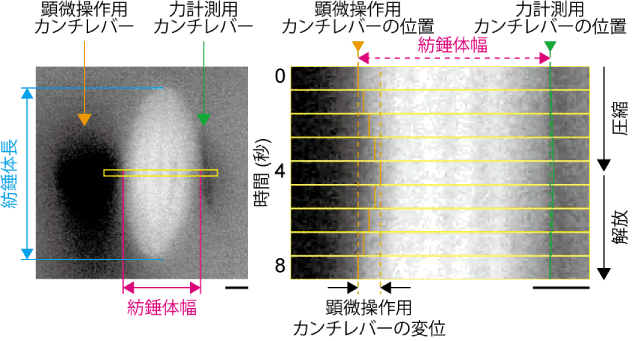
紡錘体が発生する力の細胞分裂への作用
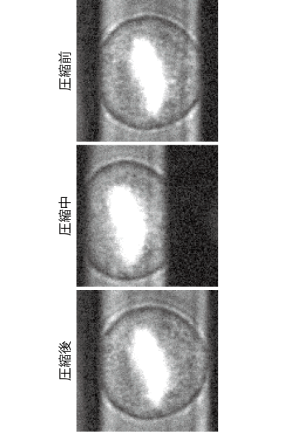
分裂期にある細胞の内外で働く力は、細胞骨格を介して、細胞の形態変化や細胞分裂の軸方向の決定などの機能に関わっている。本研究室では、MEMSカンチレバーを用いて、培養細胞を顕微操作することで、細胞分裂の進行を制御することに成功している(詳細)[3](図2)。この研究により、細胞を圧縮する方向や大きさを変えることで、細胞膜を介して紡錘体に働く張力を可逆的に増減できること、また、染色体分配の開始を早めたり遅めたりできることが分かった(図3)。この結果は、様々な細胞機能が外部から物理的に補完・制御可能であることを示唆する。
| 
|
|---|---|
| 図2:細胞分裂期細胞の顕微操作像 | 図3:外部負荷による染色体分配開始の制御 |
注)MEMS(Micro Electro Mechanical Systems:微小電気機械)デバイスとは、半導体技術を用いて製作したマイクロ(10-6)メートルオーダーのデバイスである。
参考文献
[1] Itabashi, T. et al., Nat. Methods 6, 167-172 (2009) [article | press release]
[2] Takagi, J. et al., in preparation/Submitted (2012)
[3] Itabashi, T. et al., Proc. Natl. Acad. Sci. USA 109, 7320-7325 (2012) [article | press release]
単一細胞の温度を測る & 制御する
温度は細胞の多くの反応に影響することが知られています。たとえば温度が高くなると細胞分裂の周期は短くなり、心筋細胞の拍動は早くなります。ここでの温度とは、溶液全体の温度など、細胞にとって「大きな温度」です。
一方で、私たちは細胞内部の局所的な温度、「小さな温度」に注目して研究しています。そのために、①細胞の局所的な温度を測定する方法と、②細胞に局所的な温度変化を与える手法を開発してきました。
①細胞の局所的な温度を測る(蛍光温度測定法)
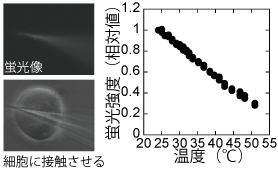
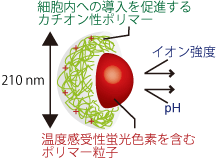
私たちは蛍光色素の明るさ(蛍光強度)が温度によって変化する性質を利用して、蛍光顕微鏡観察から温度を測定しています。温度感受性のある蛍光色素をガラス微小管につめて温度を測るミクロ温度計(図1)を開発し[1]、HeLa細胞1つに接触させて、細胞内Ca2+上昇にともなう1 ℃の微小な温度上昇を正確に測定することに成功しています[2]。また、蛍光強度が温度以外の環境因子(pHやイオン強度など)に影響しないナノ温度計粒子も開発しました(図2)[3]。
| 
|
|---|---|
| 図1:ミクロ温度計 (ガラス管内に蛍光色素を封入) |
図2:ナノ温度計(早稲田大学生命医科学科 武岡研究室との共同開発) |
②細胞に局所的な温度変化を与える(局所熱パルス法)
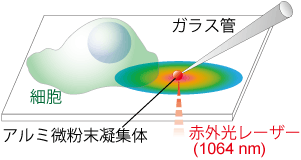
|
|---|
| 図3:ミクロヒーター |
私たちは赤外光レーザーを金属粒子に集光し、局所空間(数10マイクロメートル)の温度変化をすばやく(数10ミリ秒以内)生み出す方法(ミクロヒーター)を開発しました(図3)[1]。この手法でHeLa細胞に熱パルス(2秒間の温度上昇)を与えたところ、わずか0.2 ℃の温度変化で細胞内Ca2+上昇が起こることを見つけました[4]。最近では、水に直接吸収される波長の赤外光レーザーを用いて、心筋細胞に熱パルスを与え、収縮・拍動させることにも成功しています[5]。
①と②を組み合わせて、細胞内のナノ温度計を包んだ顆粒(エンドソーム)の移動速度が、熱パルスによって加速することも見つけています(細胞内を歩くナノ温度計)[3]。

| 
|
|---|---|
| 熱パルスを与えた際のHeLa細胞内Ca2+の上昇の様子。左中央の明るい輝点は熱源、右上の“Open”はレーザー照射時を示す。 | 熱パルスを与えた際のラット心筋細胞の収縮。下にあらわれる黒点は、水に吸収される赤外レーザーの集光点。スケールバーは20 μm。 |
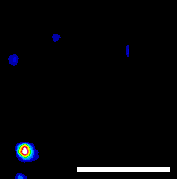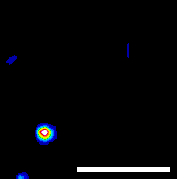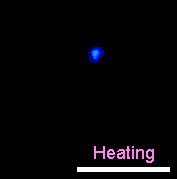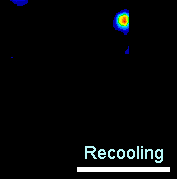
|
|---|
| ナノ温度計がエンドソームに包まれて細胞内を輸送されている様子。赤外レーザーで加熱すると、蛍光強度が下がり、移動速度は上昇する。スケールバーは5 μm。 |
このように、局所的な温度を測定・制御することで、細胞の新しい発熱現象や温度感受性を明らかにしてきました。私たちの研究を通して、「細胞が局所的な温度変化をいかに生み出し、感じて、有効に利用しているか」の実験的証拠が、ひとつひとつ、明らかになりつつあります。
参考文献
[1] Zeeb, V. et al., J. Neurosci. Meth. 139, 69-77 (2004) [article]
[2] Suzuki, M. et al., Biophys. J. 92, L46-L48 (2007) [article]
[3] Oyama, K. et al., Lab Chip 12, 1591-1593 (2012) [article]
[4] Tseeb, V. et al., HFSP J. 3, 117-123 (2009) [article]
[5] Oyama, K. et al., Biochem. Biophys. Res. Commun. 417, 607-612 (2012) [article]
Copyright © Shin'ichi Ishiwata. No reproduction or republication without written permission.